分享 | 临床风险管理计划撰写-澳门凯发
“临床风险管理计划(rmp)”是为了识别和描述重要的已识别风险、重要的潜在风险和重要的缺失信息,进而提出与风险相匹配的药物警戒活动和风险管理措施,以确保适应症人群在用药过程中保持获益大于风险。本文作者根据自身撰写的 rmp,总结以下内容与各同行交流分享。
(一)安全性概述
按照《e2e:药物警戒计划》,安全性概述应当是“一个关于药物重要的已识别风险,重要的潜在风险和重要的缺失信息的摘要”。简而言之,撰写安全性概述需要从“药物的用途、药物的风险、药物的适用范围”进行阐述。因此,又将安全性概述分为三部分:目标适应症流行病学、重要的已识别/潜在风险、重要的缺失信息。
在对药品进行风险识别时,适应症的疾病特征和人群大小对风险是否影响获益平衡的结论产生重要影响,因此需要首先对目标适应症的流行病学信息进行总结。
检索相关资料的主要方向,如:人群基本流行病学数据和特征、自然病程特征、人群重要的合并疾病及合并用药以及目前可及的治疗手段等相关信息的摘要。
实际撰写时,可以考虑参考项目已有的资料与适应症治疗指南,同时也要进行文献检索,以获取最新的信息。
风险,是不良反应,但不是所有的不良反应都是风险。rmp 应聚焦解决不良临床结局,有足够的科学证据证明是由药物引起的风险。因此对重要风险的分析和评价变得尤为重要。
❖ 风险类别:重要风险被区分为“已识别”和“潜在”两类风险。实际撰写时,可以参考同类药物的说明书及风险管理计划,结合自己已有的临床/非临床数据进行分析。
❖ 风险名称:建议尽量使用国际医学用于词典[meddra]术语,选择更为贴切的风险名称。
❖ 确定重要的已识别风险/重要的潜在风险:“安全性概述”部分的主体内容是对重要风险的分析和评价,无论针对的是何种适应症和目标人群,在确定风险是否重要是,应该考虑以下因素:
(1)风险的医学重要性;
(2)发生频率、可预测性、可预防性和可逆性;
(3)对公众健康的潜在因素。
通过上述内容,便于对风险的识别和确定,之后根据风险机制、非临床数据以及临床数据三方面进行论证。我在撰写过程中更多关注的是临床数据,参考同类药物以及自己本身的数据。
❖ 重要的缺失信息:指对药品某方面的安全性特征或某特定人群使用该药品的风险获益信息存在缺失,且这些缺失的信息是临床所关注的。
实际撰写过程中,需要对列为缺失信息的数据进行论证说明,说明作为缺失数据的原因、对被超适应症使用的可能性进行评估。
(二)药物警戒活动
药物警戒活动的目的是进一步描述和量化风险特征、确认或消除潜在风险、识别新的风险、收集缺失信息领域的信息以及评估风险控制措施的有效性。药物警戒活动计划包括常规药物警戒活动和额外药物警戒活动。
常规药物警戒活动是所有药品必须进行的主要/最低限度的药物警戒活动组合。申请人应遵从法规要求计划并实施活动,包括:建立收集、报告不良反应的系统和程序;向监管部门报告药物的不良反应;dsur/psur的递交;持续性监测收集安全信号;更新说明书以及药品监管机构规定的其他要求等。
额外的药物警戒活动是非临床研究或以安全性为目的临床试验和/或非干预性研究等。申请人应该对每项额外的药物警戒活动的目的和必要性进行说明。如需开展,建议以活动类型为中心撰写相关内容,而不是以风险为中心进行撰写。
风险控制措施是以安全性概述为基础,制定与药物风险相匹配的风险控制措施,目的在于预防/降低重要风险的发生。风险控制措施包括常规风险控制措施和特殊风险控制措施。
01、常规风险控制措施:常规风险控制措施适用于所有药品,包括修订药品说明书、标签、包装,采用适当的药品处方形势和管理状态等。
在撰写常规风险管理措施时,根据安全性信息中所确定的风险/缺失信息进行制定,一般常见于自拟说明书/可预防性中,如说明书中用法用量、禁忌、警告、注意事项、不良反应等章节。
02、特殊风险控制措施
特殊风险控制措施通常包括风险沟通、教育计划、患者日记、处方限制项目、受控分销、疾病/药物登记招募计划、避孕计划等。只有当常规风险控制措施无法达到预期效果时才实施特殊风险控制措施。
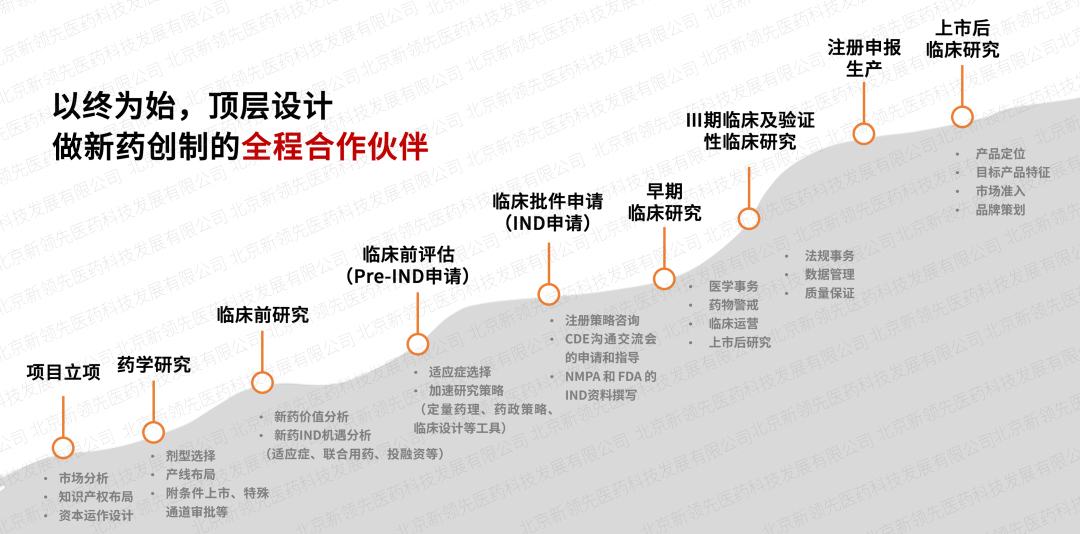
深蓝海生物医药是新领先在临床cro领域的子品牌,成立于2007年,目前已拥有高专业水准的临床服务团队600余人,已为300余家国内外知名企业提供多元化的研发支持临床技术服务,项目全面覆盖生物药、化药、中药、医疗器械、细胞与基因治疗等药物,满足不同研发型企业的临床研究定制需求,为国内外客户打通新药上市前关键瓶颈。通过16年经验积累,深蓝海生物医药已经完成临床研究500余项,每年开展ⅰ类创新药研究10-20项,率先开展医美、特医食品、细胞与基因治疗药物等领域研究,填补国内外多项空白。
依托于新领先cxo服务体系,创建了“交互式”临床服务模式,在项目立项阶段全面介入,做新药创制的全程澳门凯发的合作伙伴,整合医学、药政、药学研发等技术专家进行顶层设计,最大限度降低项目研发风险。同时,成立专项政府引导基金,为创新项目提供不同阶段的投融资,最大程度加速药品上市进程。此外,强大的定量药理学及体内外桥接团队针对特定疾病和特定人群进行数字模型研究,制定科学高质的临床研究方案,提高新药临床开发效率。
-end-


转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。
 hotline服务热线:010-61006450
hotline服务热线:010-61006450


 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部邮箱:
技术市场部邮箱: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450
